Πώς να βρείτε τη μοριακή μάζα
Στην πρακτική και θεωρητική χημεία υπάρχουν επίσηςέχουν δύο πρακτικές έννοιες όπως η μοριακή (συχνά αντικαθίσταται από την έννοια του μοριακού βάρους, που δεν είναι σωστή) και τη μοριακή μάζα. Και οι δύο αυτές ποσότητες εξαρτώνται από τη σύνθεση μιας απλής ή πολύπλοκης ουσίας.
Πώς να προσδιορίσετε τη μοριακή μάζα ή το μοριακό βάρος; Και οι δύο αυτές φυσικές ποσότητες δεν μπορούν (ή σχεδόν δεν) να βρεθούν με άμεση μέτρηση, για παράδειγμα, με τη ζύγιση μιας ουσίας σε κλίμακα. Υπολογίζονται από τον χημικό τύπο της ένωσης και από τις ατομικές μάζες όλων των στοιχείων. Αυτές οι ποσότητες είναι αριθμητικά ίσες, αλλά διαφέρουν ως προς τη διάσταση. Η μοριακή μάζα εκφράζεται με ατομικές μονάδες μάζας, οι οποίες είναι υπό όρους, έχουν τον χαρακτηρισμό α. e. m., αλλά και ένα άλλο όνομα - "dalton". Οι μονάδες μοριακής μάζας εκφράζονται σε g / mol.
Οι μοριακές μάζες απλών ουσιών, τα μόρια των οποίων αποτελούνται από ένα άτομο, είναι ίσες με τις ατομικές τους μάζες, οι οποίες υποδεικνύονται στον περιοδικό πίνακα του Mendeleyev. Για παράδειγμα, για:
- νατρίου (Na) - 22,99 α. ε.
- σίδηρος (Fe) - 55,85 α. ε.
- θείο (S) - 32.064 α. ε.
- Αργόν (Ar) 39.948 α. ε.
- Κάλιο (Κ) - 39.102 α. ε. m.
Επίσης, οι μοριακές μάζες των απλών ουσιών,των οποίων τα μόρια αποτελούνται από διάφορα άτομα ενός χημικού στοιχείου, υπολογίζονται ως το προϊόν της ατομικής μάζας του στοιχείου από τον αριθμό των ατόμων στο μόριο. Για παράδειγμα, για:
- Οξυγόνο (Ο2) - 16 • 2 = 32 α. ε.
- άζωτο (Ν2) - 14 • 2 = 28 α. ε.
- χλώριο (Cl2) -35 • 2 = 70 a. ε.
- Όζον (Ο3) - 16 • 3 = 48 α. ε. m.
Υπολογίστε τις μοριακές μάζες σύνθετων ουσιών, αθροίζοντας τα προϊόντα της ατομικής μάζας με τον αριθμό των ατόμων για το συστατικό του μορίου κάθε στοιχείου. Για παράδειγμα, για:
- Υδροχλωρικό οξύ (HCl) - 2 + 35 = 37 α. ε.
- μονοξείδιο του άνθρακα (CO) - 12 + 16 = 28 α. ε.
- διοξείδιο του άνθρακα (CO2) - 12 + 16 • 2 = 44 α. ε. m.
Αλλά πώς να βρείτε τη μοριακή μάζα των ουσιών;
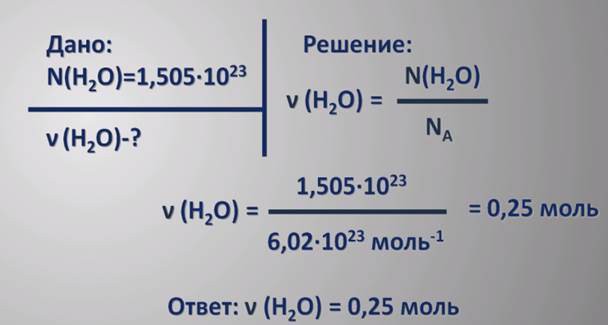
Αυτό δεν είναι δύσκολο να γίνει, αφού είναι μάζαμονάδα της ποσότητας μιας συγκεκριμένης ουσίας που εκφράζεται σε γραμμομόρια. Δηλαδή, εάν το υπολογισμένο μοριακό βάρος κάθε ουσίας πολλαπλασιάζεται με μία σταθερή τιμή ίση προς 1 g / mol, αποδεικνύεται γραμμομοριακή μάζα του. Για παράδειγμα, πώς να βρει την γραμμομοριακή μάζα του διοξειδίου του άνθρακα (CO2); Θα πρέπει να είναι (12 + 16 • 2) • 1 g / mole = 44 g / mol, δηλαδή MSO2 = 44 g / mol. Για απλές ουσίες, μόρια, η οποία περιέχει μόνο ένα άτομο στοιχείο αυτό δείκτη, που εκφράζεται σε g / mole συμπίπτει αριθμητικά με ατομικό στοιχείο μάζας. Για παράδειγμα, για θείο MS = 32,064 g / mol. Πώς να βρείτε τη γραμμομοριακή μάζα ενός απλού ουσίας, του οποίου το μόριο αποτελείται από διάφορα άτομα, μπορεί κανείς να εξετάσει για παράδειγμα το οξυγόνο: ΜΟ2 = 2 • 16 = 32 g / mol.
Εδώ ήταν παραδείγματα για συγκεκριμένααπλές ή σύνθετες ουσίες. Αλλά είναι δυνατόν και πώς να βρείτε τη μοριακή μάζα ενός προϊόντος που αποτελείται από πολλά συστατικά; Όπως και η μοριακή, μοριακή μάζα ενός μείγματος πολλών συστατικών είναι μια ποσότητα προσθέτου. Είναι το άθροισμα των προϊόντων της γραμμομοριακής μάζας του συστατικού στο κλάσμα του στο μείγμα: M = ΣMi · Xi, δηλαδή το μέσο μοριακό βάρος και η μέση μοριακή μάζα μπορούν να υπολογιστούν.
Στο παράδειγμα του αέρα, που περιλαμβάνειπερίπου 75,5% άζωτο, 23,15% οξυγόνο, 1,29% αργόν, 0,046% διοξείδιο του άνθρακα (οι υπόλοιπες ακαθαρσίες που περιέχονται σε μικρότερες ποσότητες, μπορεί να αγνοηθεί): Mvozduha = 28 • 0755 + 32 • 0,2315 + 40 • 0,129 + 44 • 0,00046 = 29,08424 g / mol ≈ 29 g / mol.
Πώς να βρείτε τη μοριακή μάζα μιας ουσίας, αν η ακρίβειαο προσδιορισμός των ατομικών μαζών που υποδεικνύεται στον περιοδικό πίνακα είναι διαφορετικός; Για ορισμένα στοιχεία που περιέχει μέχρι ένα δέκατο, για το άλλο με δύο δεκαδικά ψηφία, για την τρίτη στο χιλιοστό, και όπως το ραδόνιο - σε ποσοστό ως και, μέχρι δέκα χιλιοστά του μαγγανίου.
Κατά τον υπολογισμό της μοριακής μάζας, δεν έχει κανένα νόημα να οδηγείυπολογισμούς με μεγαλύτερη ακρίβεια από το ένα δέκατο, δεδομένου ότι έχουν πρακτική εφαρμογή, όταν η καθαρότητα των ίδιων των χημικών ή των αντιδραστηρίων θα προκαλέσει ένα μεγάλο σφάλμα. Όλοι αυτοί οι υπολογισμοί είναι κατά προσέγγιση. Όμως, όπου απαιτείται περισσότερη ακρίβεια για τους χημικούς, γίνονται κατάλληλες διορθώσεις με ορισμένες διαδικασίες: καθορίζεται ένας τίτλος διαλύματος, γίνεται βαθμονόμηση σύμφωνα με τυποποιημένα δείγματα και ούτω καθεξής.
</ p></ p>