Ο βαθμός οξείδωσης είναι τι αξία; Πώς να καθορίσετε τον βαθμό οξείδωσης των στοιχείων;
Ένα τέτοιο θέμα του σχολικού προγράμματος σπουδών ως χημείαπροκαλεί πολλές δυσκολίες στην πλειοψηφία των σημερινών φοιτητών, πολύ λίγοι άνθρωποι θα μπορούσαν να καθορίσουν το βαθμό οξείδωσης στις ενώσεις. Η μεγαλύτερη δυσκολία σε παιδιά σχολικής ηλικίας που μελετούν ανόργανη χημεία, που είναι, οι μαθητές του δημοτικού σχολείου (8-9 βαθμοί). Αντικείμενο παρεξήγηση οδηγεί σε αντιπαθούν μαθητές με το θέμα.
Οι εκπαιδευτικοί εντοπίζουν διάφορους λόγους γι 'αυτό"Απάτη" των μεσαίων και ανώτερων φοιτητών στη χημεία: απροθυμία να κατανοήσουν περίπλοκους χημικούς όρους, αδυναμία χρήσης αλγορίθμων για να εξετάσουν μια συγκεκριμένη διαδικασία, προβλήματα με τη μαθηματική γνώση. Το Υπουργείο Παιδείας της Ρωσικής Ομοσπονδίας εισήγαγε μια σημαντική αλλαγή στο περιεχόμενο του θέματος. Επιπλέον, "περικοπή" και ο αριθμός των ωρών διδασκαλίας χημείας. Αυτό επηρέασε αρνητικά την ποιότητα της γνώσης σχετικά με το θέμα, μείωση του ενδιαφέροντος για τη μελέτη της πειθαρχίας.

Ποια θέματα του μαθήματος της χημείας είναι δυσκολότερα για τους μαθητές;
Στο πλαίσιο του νέου προγράμματος κατά τη διάρκεια της ακαδημαϊκής πειθαρχίαςΗ «χημεία» του κύριου σχολείου περιελάμβανε αρκετά σοβαρά θέματα: περιοδικό πίνακα των στοιχείων του DI Mendeleyev, κατηγορίες ανόργανων ουσιών, ανταλλαγή ιόντων. Είναι πολύ δύσκολο για τους ογδόους να καθορίσουν την κατάσταση οξείδωσης των οξειδίων.
Κανόνες της ρύθμισης
Πρώτα απ 'όλα, οι μαθητές πρέπει να γνωρίζουν ότι τα οξείδιαείναι σύμπλοκες ενώσεις δύο-στοιχείο του οποίου η σύνθεση περιλάμβανε οξυγόνου. Ένα προαπαιτούμενο δυαδική ένωση που ανήκει στην κατηγορία των οξειδίων είναι οξυγόνο δεύτερη θέση σε μια δεδομένη ένωση.
Υπολογίστε έναν τέτοιο δείκτη σε οποιονδήποτε τύπο αυτής της τάξης θα αποκτηθεί μόνο αν ο μαθητής έχει έναν συγκεκριμένο αλγόριθμο.
Αλγόριθμος για τα οξείδια του οξέος
Αρχικά, σημειώστε ότι ο βαθμός οξείδωσης είναιαριθμητικές εκφράσεις για το σθένος των στοιχείων. Τα όξινα οξείδια σχηματίζονται από μη-μέταλλα ή μέταλλα με σθένος τεσσάρων έως επτά, οξυγόνο είναι το δεύτερο σε τέτοια οξείδια.
Στα οξείδια, το σθένος οξυγόνου είναι πάντααντιστοιχεί σε δύο, μπορεί να είναι καθορίσει, σύμφωνα με στοιχεία του περιοδικού πίνακα των Mendeleev. Αυτό είναι ένα τυπικό μη-μέταλλο όπως το οξυγόνο, ενώ στην ομάδα 6 του περιοδικού πίνακα του κύριου υποομάδας, δέχεται δύο ηλεκτρόνια, προκειμένου να ολοκληρωθεί πλήρως το εξωτερικό επίπεδο της ενέργειας του. Μη μέταλλα στις ενώσεις οξυγόνου συχνά εμφανίζουν τον υψηλότερο σθένος που αντιστοιχεί στον αριθμό της ίδιας της ομάδας. Είναι σημαντικό να υπενθυμίσουμε ότι ο βαθμός οξείδωσης των χημικών στοιχείων είναι ένας δείκτης υποθέτοντας μια θετική (αρνητική) αριθμός.
Το μη-μέταλλο στην αρχή του τύπου έχειμια θετική κατάσταση οξείδωσης. Το μη μεταλλικό οξυγόνο στα οξείδια είναι σταθερό, ο δείκτης του είναι -2. Για να ελέγξει την ακρίβεια της ευθυγράμμισης των τιμών σε όξινα οξείδια πρέπει να πολλαπλασιάσουμε όλους τους αριθμούς που τίθενται στους δείκτες του συγκεκριμένου στοιχείου. Οι υπολογισμοί θεωρούνται έγκυρα εφόσον λαμβάνεται το συνολικό άθροισμα όλων των πλεονεκτημάτων και των μειονεκτημάτων των σετ 0 βαθμούς.

Σύνταξη μαθηματικών δύο στοιχείων
Ο βαθμός οξείδωσης των ατόμων των στοιχείων δίνει μια πιθανότητανα δημιουργήσετε και να καταγράψετε συνδέσεις από δύο στοιχεία. Κατά τη δημιουργία μιας φόρμουλας, για πρώτη φορά, και τα δύο σύμβολα συνταγογραφούνται δίπλα-δίπλα, το οξυγόνο είναι αναγκαστικά το δεύτερο. Πάνω από κάθε ένα από τα καταγεγραμμένα σημεία, καθορίζονται οι τιμές των βαθμών οξείδωσης, τότε ανάμεσα στους αριθμούς που βρέθηκαν είναι ο αριθμός που θα χωριστεί και στα δύο ψηφία χωρίς κανένα υπόλοιπο. Αυτός ο δείκτης πρέπει να διαιρείται χωριστά με την αριθμητική τιμή του βαθμού οξείδωσης, λαμβάνοντας δείκτες για το πρώτο και το δεύτερο συστατικό της ουσίας δύο στοιχείων. Ο υψηλότερος βαθμός οξείδωσης είναι ίσος αριθμητικά με την τιμή του υψηλότερου σθένος ενός τυπικού μη μεταλλικού, ταυτόσημου με τον αριθμό της ομάδας όπου το μη-μέταλλο στο PS είναι.
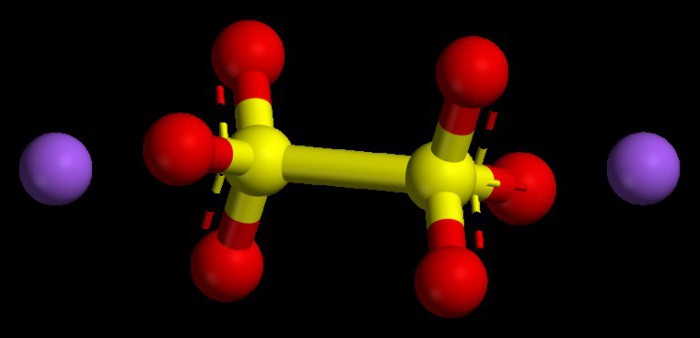
Αλγόριθμος για τον καθορισμό αριθμητικών τιμών σε βασικά οξείδια
Παρόμοιες ενώσεις είναι τα τυπικά οξείδιαμέταλλα. Σε όλες τις ενώσεις έχουν έναν δείκτη οξειδώσεως όχι μεγαλύτερου από +1 ή +2. Για να καταλάβουμε τι θα είναι ο βαθμός οξείδωσης του μετάλλου, μπορούμε να χρησιμοποιήσουμε το περιοδικό σύστημα. Για τα μέταλλα των κύριων υποομάδων της πρώτης ομάδας, αυτή η παράμετρος είναι πάντα σταθερή, είναι παρόμοια με τον αριθμό ομάδας, δηλαδή +1.
Τα μέταλλα της κύριας υποομάδας της δεύτερης ομάδας επίσηςπου χαρακτηρίζεται από σταθερό βαθμό οξείδωσης, σε αριθμητικούς όρους +2. Οι βαθμοί οξείδωσης των οξειδίων στο σύνολο, λαμβανομένων υπόψη των δεικτών τους (αριθμοί) πρέπει να δίνουν μηδέν, δεδομένου ότι ένα χημικό μόριο θεωρείται ουδέτερο, χωρίς φορτίο, ένα σωματίδιο.
Η διάταξη βαθμών οξείδωσης σε οξέα που περιέχουν οξυγόνο
Τα οξέα είναι σύνθετες ουσίες,που αποτελείται από ένα ή περισσότερα άτομα υδρογόνου, τα οποία συνδέονται με ορισμένα όξινα κατάλοιπα. Δεδομένου ότι οι καταστάσεις οξείδωσης είναι ψηφιακοί δείκτες, ορισμένες μαθηματικές δεξιότητες θα απαιτηθούν για τον υπολογισμό τους. Ένας τέτοιος δείκτης για το υδρογόνο (πρωτόνιο) στα οξέα είναι πάντα σταθερός, είναι +1. Στη συνέχεια, μπορείτε να υποδείξετε τον βαθμό οξείδωσης για το αρνητικό ιόν οξυγόνου, είναι επίσης σταθερό, -2.
Μόνο μετά από αυτές τις ενέργειες, μπορείτε να υπολογίσετεο βαθμός οξείδωσης στο κεντρικό συστατικό του τύπου. Ως ειδικό δείγμα εξετάσει στοιχεία που καθορίζουν το βαθμό οξείδωσης σε θειικό οξύ, H2SO4. Δεδομένου ότι στο μόριο του συμπλέγματος ουσίας περιέχει δύο πρωτονίων υδρογόνου, 4 άτομα οξυγόνου, παίρνουμε μια έκφραση της μορφής + 2 + Χ-8 = 0. Προκειμένου να άθροισμα που σχηματίζεται μηδέν, το γ είναι ο βαθμός οξείδωσης του θείου +6
Η διάταξη βαθμών οξείδωσης σε άλατα
Τα άλατα είναι σύνθετες ενώσεις,που αποτελείται από ιόντα μετάλλων και ένα ή περισσότερα υπολείμματα οξέος. Η διαδικασία για τον προσδιορισμό των βαθμών οξείδωσης σε κάθε ένα από τα συστατικά σε ένα σύμπλοκο άλας είναι η ίδια όπως στα οξέα που περιέχουν οξυγόνο. Δεδομένου ότι ο βαθμός οξείδωσης των στοιχείων είναι ένας ψηφιακός δείκτης, είναι σημαντικό να προσδιοριστεί σωστά ο βαθμός οξείδωσης του μετάλλου.
Εάν το μέταλλο που σχηματίζει το αλάτι βρίσκεται στοη κύρια υποομάδα, ο βαθμός οξείδωσης θα είναι σταθερός, αντιστοιχεί στον αριθμό ομάδας, είναι θετική τιμή. Αν το άλας περιέχει μέταλλο παρόμοιας υποομάδας του PS, που παρουσιάζει διαφορετικά σθένη, το σθένος του μετάλλου μπορεί να προσδιοριστεί από το όξινο κατάλοιπο. Μόλις επιτευχθεί η κατάσταση οξείδωσης του μετάλλου, ρυθμίζεται η κατάσταση οξείδωσης του οξυγόνου (-2), τότε ο βαθμός οξείδωσης του κεντρικού στοιχείου υπολογίζεται χρησιμοποιώντας τη χημική εξίσωση.
Για παράδειγμα, ας εξετάσουμε τον ορισμόβαθμοί οξείδωσης σε στοιχεία σε νιτρικό νάτριο (μεσαίο άλας). NaN03. Το άλας σχηματίζεται από το μέταλλο της κύριας υποομάδας της ομάδας 1, επομένως ο βαθμός οξείδωσης του νατρίου θα είναι +1. Το οξυγόνο στα νιτρικά έχει έναν βαθμό οξείδωσης -2. Για να προσδιοριστεί η αριθμητική τιμή του βαθμού οξείδωσης, η εξίσωση είναι + 1 + Χ-6 = 0. Επίλυση αυτής της εξίσωσης, παίρνουμε ότι το Χ πρέπει να είναι +5, αυτός είναι ο βαθμός οξείδωσης του αζώτου.

Βασικοί όροι στην OVR
Για την οξείδωση, καθώς και τη διαδικασία ανάκαμψης, υπάρχουν ειδικοί όροι που απαιτείται να μάθουν οι μαθητές.
Ο βαθμός οξείδωσης ενός ατόμου είναι η άμεση ικανότητα του να προσκολλάται (να δώσει σε άλλους) ηλεκτρόνια από μερικά ιόντα ή άτομα.
Οξειδωτικό θεωρείται ότι είναι ουδέτερα άτομα ή φορτισμένα ιόντα, κατά τη διάρκεια μιας χημικής αντίδρασης προσδίδουν ηλεκτρόνια στον εαυτό τους.
Ο αποκαταστατής θα είναι αφόρτιστα άτομα ή φορτισμένα ιόντα, τα οποία χάνουν τα δικά τους ηλεκτρόνια στη διαδικασία χημικής αλληλεπίδρασης.
Η οξείδωση αντιπροσωπεύεται ως διαδικασία για την απελευθέρωση ηλεκτρονίων.
Η ανάκτηση σχετίζεται με την αποδοχή πρόσθετων ηλεκτρονίων από ένα αφόρτιστο άτομο ή ιόν.
Μέθοδος οξείδωσης-μείωσηςπου χαρακτηρίζεται από μια αντίδραση στην πορεία της οποίας ο βαθμός οξείδωσης του ατόμου αλλάζει αναγκαστικά. Αυτός ο ορισμός μας επιτρέπει να κατανοήσουμε πώς είναι δυνατόν να καθοριστεί αν η αντίδραση OVR είναι.

Κανόνες για την ανάλυση του IAD
Χρησιμοποιώντας αυτόν τον αλγόριθμο, μπορείτε να οργανώσετε τους συντελεστές σε οποιαδήποτε χημική αντίδραση.
Πρώτα πρέπει να κανονίσετε σε κάθε χημικόουσίας της κατάστασης οξείδωσης. Σημειώστε ότι σε μια απλή ουσία ο βαθμός οξείδωσης είναι μηδέν, αφού δεν υπάρχει ανάκρουση αρνητικών σωματιδίων. Οι κανόνες για τη ρύθμιση των βαθμών οξείδωσης σε δυαδικές και τριών στοιχειωδών ουσιών εξετάστηκαν παραπάνω.
Στη συνέχεια, είναι απαραίτητο να προσδιοριστούν εκείνα τα άτομα ή τα ιόντα στα οποία οι καταστάσεις οξείδωσης έχουν αλλάξει κατά τη διάρκεια του μετασχηματισμού που συνέβη.
Από την αριστερή πλευρά της εξίσωσης που γράφτηκε κάτω,άτομα ή φορτισμένα ιόντα που έχουν αλλάξει τις καταστάσεις οξείδωσης τους. Αυτό είναι απαραίτητο για την εξισορρόπηση. Τα στοιχεία υποδεικνύονται πάντα από τις τιμές τους.
Επιπλέον, αυτά τα άτομα ή τα ιόντα πουσχηματίστηκαν κατά τη διάρκεια της αντίδρασης, που υποδεικνύεται από το σύμβολο + τον αριθμό των ηλεκτρονίων που λαμβάνονται από το άτομο, - τον αριθμό αρνητικών σωματιδίων που δόθηκαν. Εάν τα επίπεδα οξείδωσης μειωθούν μετά τη διαδικασία αντίδρασης. Αυτό σημαίνει ότι τα ηλεκτρόνια λήφθηκαν από ένα άτομο (ιόν). Με την αύξηση του βαθμού οξείδωσης, το άτομο (ιόν) κατά τη διάρκεια της αντίδρασης εκπέμπει ηλεκτρόνια.
Ο μικρότερος συνολικός αριθμός διαιρείται πρώτα στους λαμβανόμενους συντελεστές, κατόπιν στα ηλεκτρόνια που μεταφέρονται στη διαδικασία. Οι αριθμοί που βρέθηκαν είναι οι απαιτούμενοι στερεοχημικοί συντελεστές.
Προσδιορίστε τον οξειδωτή, αναγωγικό παράγοντα, τις διεργασίες που εμφανίζονται κατά τη διάρκεια της αντίδρασης.
Το τελευταίο βήμα θα είναι η διευθέτηση των στερεοχημικών συντελεστών στην υπό εξέταση αντίδραση.
Παράδειγμα OBR
Εξετάστε την πρακτική εφαρμογή αυτού του αλγορίθμου σε μια συγκεκριμένη χημική αντίδραση.
Fe + CuSO4 = Cu + FeS04
Υπολογίζουμε τις παραμέτρους για όλες τις απλές και σύνθετες ουσίες.
Δεδομένου ότι τα Fe και Cu είναι απλές ουσίες, ο βαθμός οξείδωσης τους είναι 0. Σε CuSO4, στη συνέχεια Cu + 2, στη συνέχεια για οξυγόνο-2 και για θείο +6. Σε FeSO4: Fe + 2, ως εκ τούτου, για το Ο-2, σύμφωνα με τους υπολογισμούς του S +6.
Τώρα ψάχνουμε για στοιχεία που θα μπορούσαν να αλλάξουν τους δείκτες, στην κατάσταση μας θα είναι Fe και Cu.
Δεδομένου ότι μετά την αντίδραση η τιμή του ατόμου σιδήρουέγιναν +2, δόθηκαν 2 ηλεκτρόνια στην αντίδραση. Ο χαλκός άλλαξε την απόδοσή του από +2 σε 0, επομένως ο χαλκός πήρε 2 ηλεκτρόνια. Τώρα προσδιορίζουμε τον αριθμό των λαμβανόμενων και των δεδομένων ηλεκτρονίων από το άτομο σιδήρου και το κατιόν του δισθενούς χαλκού. Κατά τη διάρκεια του μετασχηματισμού, λαμβάνονται δύο ηλεκτρόνια από το κατιόν του δισθενούς χαλκού, ο ίδιος αριθμός ηλεκτρονίων εκπέμπεται από το άτομο σιδήρου.
Σε αυτή τη διαδικασία, δεν έχει νόημα στον καθορισμότο ελάχιστο κοινό πολλαπλάσιο, καθώς ένας ίσος αριθμός ηλεκτρονίων είναι αποδεκτός και δίνεται κατά τη διάρκεια του μετασχηματισμού. Οι στερεοχημικοί συντελεστές θα αντιστοιχούν επίσης στην ενότητα. Στην αντίδραση, οι ιδιότητες του αναγωγικού παράγοντα θα εμφανίζουν σίδηρο, ενώ θα οξειδώνονται. Το κατιόν του δισθενούς χαλκού μειώνεται σε καθαρό χαλκό, στην αντίδραση έχει τον υψηλότερο βαθμό οξείδωσης.

Εφαρμογή διαδικασιών
Οι τύποι βαθμών οξείδωσης πρέπει να είναι γνωστοίσε κάθε τάξη μαθητών 8-9, δεδομένου ότι το θέμα αυτό περιλαμβάνεται στα καθήκοντα του OGE. Οποιεσδήποτε διαδικασίες που συμβαίνουν με οξειδωτικά, αποκαταστατικά σημεία παίζουν σημαντικό ρόλο στη ζωή μας. Χωρίς αυτές, οι μεταβολικές διαδικασίες στο ανθρώπινο σώμα είναι αδύνατες.
</ p>