Το πυρίτιο και οι ενώσεις του. Το πυρίτιο στη φύση. Εφαρμογή πυριτίου
Ένα από τα πιο δημοφιλή στην τεχνολογία καιΗ βιομηχανία στοιχείων είναι το πυρίτιο. Αυτό οφείλει τις ασυνήθιστες ιδιότητές του. Σήμερα, υπάρχουν πολλές διαφορετικές ενώσεις αυτού του στοιχείου που παίζουν σημαντικό ρόλο στη σύνθεση και τη δημιουργία τεχνικών προϊόντων, γυαλικών, εξοπλισμού, υλικών κατασκευής και φινιρίσματος, κοσμημάτων και άλλων βιομηχανιών.

Γενικά χαρακτηριστικά του πυριτίου
Εάν εξετάσουμε τη θέση του πυριτίου σε ένα περιοδικό σύστημα, τότε μπορούμε να πούμε αυτό:
- Βρίσκεται στην ομάδα IV της κύριας υποομάδας.
- Ο σειριακός αριθμός είναι 14.
- Η ατομική μάζα είναι 28.086.
- Χημικό σύμβολο Si.
- Το όνομα είναι πυρίτιο, ή στα λατινικά - πυρίτιο.
- Ηλεκτρονική διαμόρφωση της εξωτερικής στρώσης 4e: 2e: 8e.
Το κρυσταλλικό πλέγμα του πυριτίου είναι παρόμοιο με ένα πλέγμαδιαμάντι. Στους κόμβους υπάρχουν άτομα, του τύπου - κυβικά προσανατολισμένα προς το πρόσωπο. Ωστόσο, λόγω του μεγαλύτερου μήκους δεσμού, οι φυσικές ιδιότητες του πυριτίου είναι πολύ διαφορετικές από αυτές της αλλοτροπικής τροποποίησης του άνθρακα.
Φυσικές και χημικές ιδιότητες
Υπάρχουν δύο αλλοτροπικές τροποποιήσεις αυτούστοιχείο: άμορφο και κρυσταλλικό. Είναι πολύ παρόμοια. Ωστόσο, όπως και στην περίπτωση άλλων ουσιών, η κύρια διαφορά μεταξύ τους είναι το κρυσταλλικό πλέγμα του πυριτίου.
Στην περίπτωση αυτή, και οι δύο τροποποιήσεις είναι σκόνες διαφορετικών χρωμάτων.
1. Το κρυσταλλικό πυρίτιο είναι σκούρο γκρι γυαλιστερή σκόνη, παρόμοιο με το μέταλλο. Η δομή του αντιστοιχεί σε ένα διαμάντι, αλλά οι ιδιότητες είναι διαφορετικές. Έχει:
- ευπάθεια ·
- χαμηλή σκληρότητα;
- ιδιότητες ημιαγωγών ·
- σημείο τήξης 14150C;
- πυκνότητα 2.33 g / cm3.
- σημείο ζέσεως 27000Γ.
Η χημική του δραστηριότητα είναι χαμηλή σε σύγκριση με άλλη αλλοτροπική μορφή.
2. Το άμορφο πυρίτιο είναι καφέ-καστανόχρωμη σκόνη με δομή από έντονα διαταραγμένο διαμάντι. Η χημική δραστηριότητα είναι αρκετά υψηλή.
Γενικά, πρέπει να σημειωθεί ότι το πυρίτιο δεν επιθυμεί να ενταχθεί στην αντίδραση. Για να το αντιδράσετε, χρειάζεστε μια θερμοκρασία τουλάχιστον 400-5000Γ. Υπό αυτές τις συνθήκες, σχηματίζονται διάφορες χημικές ενώσεις πυριτίου. Όπως:
- οξείδια ·
- αλογονίδια.
- πυριτίδια.
- νιτρίδια.
- βορίδια.
- καρβίδια.
Η αλληλεπίδραση του πυριτίου με το νιτρικόοξύ ή αλκάλιο, το οποίο έχει το όνομα της διαδικασίας χάραξης. Οι ενώσεις σιλικόνης είναι ευρέως διαδεδομένες, οι οποίες γίνονται όλο και πιο διαδεδομένες σήμερα.
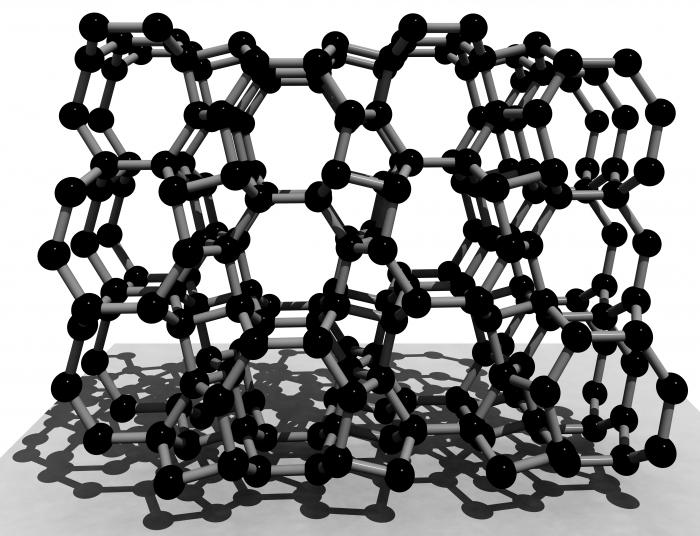
Όντας στη φύση
Το πυρίτιο στη φύση περιέχεται σε αρκετά βαρύποσότητα. Βρίσκεται στη δεύτερη θέση μετά το οξυγόνο στον επιπολασμό. Το κλάσμα μάζας του είναι περίπου 30%. Το θαλασσινό νερό περιέχει επίσης αυτό το στοιχείο σε συγκέντρωση περίπου 3 mg / l. Επομένως, δεν μπορούμε να πούμε ότι το πυρίτιο στη φύση είναι ένα σπάνιο στοιχείο.
Αντίθετα, υπάρχουν πολλά διαφορετικά πετρώματα και ορυκτά στη σύνθεση του οποίου βρίσκεται και από το οποίο μπορεί να εξαχθεί. Οι πιο κοινές φυσικές ενώσεις πυριτίου έχουν ως εξής:
- Πυρίτιο. Χημικός τύπος SiO2. Υπάρχει αρκετά μια ποικιλία των μορφών των ορυκτών και πετρωμάτων στη βάση του: την άμμο, πυρόλιθο, άστριο, χαλαζία, ορεία κρύσταλλος, αμέθυστος, χαλκηδόνιος, κορνεόλη, οπάλιο, ίασπη, και άλλα.
- Πυριτικά και αργιλοπυριτικά άλατα. Καολίνη, σπάρι, μαρμαρυγία, άλατα πυριτικού οξέος, αμίαντος, τάλκη.
Έτσι, η εξάπλωση της φύσης του πυριτίου είναι ευρέως διαδεδομένη και οι ενώσεις της είναι δημοφιλείς και απαιτητικές μεταξύ των ανθρώπων για χρήση σε τεχνικούς σκοπούς.

Το πυρίτιο και οι ενώσεις του
Δεδομένου ότι στην καθαρή του μορφή το υπό εξέταση στοιχείοΔεν μπορεί να υπάρξει, συνεπώς, οι διάφορες συνδέσεις του έχουν μεγάλη σημασία. Από χημική άποψη, μπορεί να εμφανίσει τρεις καταστάσεις οξείδωσης: +2, +4, -4. Προχωρώντας από αυτό, αλλά και από την αδράνεια του αλλά ιδιόμορφη στη δομή του κρυσταλλικού πλέγματος, σχηματίζει τους ακόλουθους κύριους τύπους ουσιών:
- Δυαδικές ενώσεις με μη μέταλλα (σιλάνιο, καρβίδιο, νιτρίδιο, φωσφίδιο και ούτω καθεξής.
- οξείδια ·
- πυριτικό οξύ.
- πυριτικά άλατα μετάλλων.
Ας εξετάσουμε λεπτομερέστερα τη σημασία του πυριτίου και των ενώσεών του, οι οποίες είναι οι πιο συνηθισμένες και ισχυρισμένες για τους ανθρώπους.

Οξείδια του πυριτίου
Υπάρχουν δύο ποικιλίες αυτής της ουσίας, που εκφράζονται από τους τύπους:
- SiO;
- SiO2.
Ωστόσο, το πιο κοινό είναι το διοξείδιο. Υπάρχει στη φύση με τη μορφή πολύ όμορφων ημιπολύτιμων λίθων:
- αχάτη;
- χαλκηδόνια.
- opal;
- carnelian;
- Jasper;
- Αμέθυστος;
- rhinestone.
Η χρήση του πυριτίου σε αυτή τη μορφή έχει βρεθείεφαρμογή στην παραγωγή κοσμημάτων. Απίστευτα όμορφα χρυσά και ασημένια κοσμήματα γίνονται με αυτές τις ημιπολύτιμες και διακοσμητικές πέτρες.
Μερικές ακόμη παραλλαγές διοξειδίου του πυριτίου:
- χαλαζία?
- ποτάμι και χαλαζιακή άμμο.
- πυρόλιθο?
- άστριο.
Η χρήση πυριτίου σε τέτοια είδη πραγματοποιείται στοέργα κατασκευής, μηχανική, ραδιόφωνο, χημική βιομηχανία, μεταλλουργία. Όλα αυτά τα οξείδια αναφέρονται σε μία μόνο ουσία - πυριτία.
Το καρβίδιο του πυριτίου και η εφαρμογή του
Το πυρίτιο και οι ενώσεις του είναι τα υλικά του μέλλοντοςκαι το παρόν. Ένα τέτοιο υλικό είναι το carborundum ή το καρβίδιο αυτού του στοιχείου. Ο χημικός τύπος είναι SiC. Εμφανίζεται στη φύση με τη μορφή ενός ορυκτού μωσαϊνίτη.
Σε καθαρή μορφή, ο συνδυασμός άνθρακα και πυριτίου είναι ένας όμορφος διαφανής κρύσταλλος που μοιάζει με δομές διαμαντιών. Ωστόσο, για τεχνικούς σκοπούς, χρησιμοποιούνται οι πράσινες και μαύρες ουσίες.
Τα κύρια χαρακτηριστικά αυτής της ουσίας, επιτρέποντάς της να χρησιμοποιηθεί στη μεταλλουργία, στη μηχανική, στη χημική βιομηχανία, έχουν ως εξής:
- ημιαγωγοί ευρείας ζώνης?
- πολύ υψηλό βαθμό αντοχής (7 στην κλίμακα Mohs).
- ανθεκτικό στις υψηλές θερμοκρασίες.
- εξαιρετική ηλεκτρική σταθερότητα και θερμική αγωγιμότητα.
Όλα αυτά καθιστούν δυνατή τη χρήση του carborundumΗ ποιότητα του λειαντικού υλικού στη μεταλλουργία και τη χημική σύνθεση. Και επίσης στη βάση του για την παραγωγή LEDs ευρείας γκάμας δράσης, λεπτομέρειες για φούρνους τήξης γυαλιού, ακροφύσια, φακούς, κοσμήματα (ο moissanite αποτιμάται πάνω από το φιανίτη).

Σίλαν και το νόημά του
Η ένωση υδρογόνου του πυριτίου έχει το όνομασιλάνιο και δεν μπορεί να ληφθεί με άμεση σύνθεση από τα αρχικά υλικά. Για την παραγωγή του, χρησιμοποιούνται πυριτίδια διαφόρων μετάλλων, τα οποία επεξεργάζονται με οξέα. Ως αποτέλεσμα, απελευθερώνεται αέριο σιλάνιο και σχηματίζεται ένα άλας μετάλλου.
Είναι ενδιαφέρον, η εν λόγω ένωσηδεν σχηματίζεται ποτέ μεμονωμένα. Πάντα ως αποτέλεσμα της αντίδρασης, λαμβάνεται ένα μίγμα μονο-, δι- και τρισιλανίου, στο οποίο τα άτομα πυριτίου συνδέονται μαζί σε αλυσίδες.
Με τις ιδιότητές τους, αυτές οι ενώσεις είναι ισχυροί αναγωγικοί παράγοντες. Οι ίδιοι εύκολα οξειδώνονται με οξυγόνο, μερικές φορές με έκρηξη. Με αλογόνα, οι τυρβώδεις αντιδράσεις είναι πάντα, με μεγάλη απελευθέρωση ενέργειας.
Οι περιοχές εφαρμογής των σιλανίων είναι οι εξής:
- Αντιδράσεις της οργανικής σύνθεσης, ως αποτέλεσμα του οποίου, είναι σημαντικό να σιλικόνες - σιλικόνη, καουτσούκ, στεγανωτικών, λιπαντικά, γαλακτώματα και άλλα.
- Μικροηλεκτρονική (οθόνες υγρών κρυστάλλων, ολοκληρωμένα τεχνικά συστήματα κ.λπ.).
- Παραγωγή πολύπυρου πολυπυριτίου.
- Οδοντιατρική στην προσθετική.
Έτσι, η σημασία των σιλανίων στον σύγχρονο κόσμο είναι υψηλή.

Πυριτικό οξύ και πυριτικά άλατα
Το υδροξείδιο του εν λόγω στοιχείου είναι διαφορετικά πυριτικά οξέα. Κατανομή:
- meta;
- ορθο;
- πολυσιλικό και άλλα οξέα.
Όλοι τους μοιράζονται κοινές ιδιότητες - ακραίεςαστάθεια στην ελεύθερη κατάσταση. Εύκολα αποσυντίθενται κάτω από την επίδραση της θερμοκρασίας. Υπό κανονικές συνθήκες, δεν υπάρχει πολύς χρόνος, μετατρέποντας πρώτα σε ένα κολλοειδές διάλυμα, και έπειτα σε πήκτωμα. Μετά την ξήρανση, οι δομές αυτές ονομάζονται πήγματα πυριτίας. Χρησιμοποιούνται ως απορροφητικά μέσα σε φίλτρα.
Σημαντικό από βιομηχανική άποψη είναι τα άλατα πυριτικών οξέων - πυριτικών αλάτων. Αποτελούν τη βάση για την απόκτηση τέτοιων ουσιών όπως:
- γυαλί?
- σκυρόδεμα ·
- τσιμέντο ·
- ζεόλιθος;
- καολίνη.
- πορσελάνη;
- φαγεντιανή?
- κρύσταλλο ·
- κεραμικά.
Τα πυριτικά άλατα αλκαλιμετάλλων είναι διαλυτά, όλα τα άλλα δεν είναι. Ως εκ τούτου, το πυριτικό νάτριο και κάλιο ονομάζεται υγρό γυαλί. Η συνήθης κόλλα γραφείου είναι το άλας νατρίου του πυριτικού οξέος.
Αλλά οι πιο ενδιαφέρουσες ενώσεις είναι όλεςτο ίδιο γυαλί. Ποιες είναι οι μοναδικές παραλλαγές αυτής της ουσίας που εφευρέθηκε! Σήμερα, λαμβάνουν χρώμα, οπτικές, ματ επιλογές. Τα γυαλικά εκπλήσσουν με τη λαμπρότητα και την ποικιλία τους. Όταν ορισμένα μείγματα οξειδίων και μη μέταλλα προστίθενται στο μείγμα, μπορεί να παραχθεί μια ποικιλία τύπων γυαλιού. Μερικές φορές ακόμη και η ίδια σύνθεση, αλλά ένα διαφορετικό ποσοστό των συστατικών οδηγεί σε διαφορά στις ιδιότητες της ουσίας. Ένα παράδειγμα είναι πορσελάνη και φαγεντιανή, η φόρμουλα της οποίας είναι SiO2* AL2Ο3* Κ2Ο.
Το γυαλί χαλαζία είναι μια μορφή ενός ιδιαίτερα καθαρού προϊόντος, η σύνθεση του οποίου περιγράφεται ως διοξείδιο του πυριτίου.

Ανακαλύψεις στον τομέα των ενώσεων πυριτίου
Τα τελευταία χρόνια, έχει γίνει έρευνααποδεικνύεται ότι το πυρίτιο και οι ενώσεις του είναι οι σημαντικότεροι συμμετέχοντες στην κανονική κατάσταση των ζώντων οργανισμών. Με ανεπάρκεια ή περίσσεια αυτού του στοιχείου, ασθένειες όπως:
- καρκίνο;
- φυματίωση;
- αρθρίτιδα;
- Καταρράκτης.
- λέπρα ·
- δυσεντερία;
- ρευματισμούς;
- ηπατίτιδα και άλλα.
Οι διαδικασίες γήρανσης του οργανισμού σχετίζονται επίσης μεποσοτικού περιεχομένου πυριτίου. Πολλά πειράματα σε θηλαστικά έχουν δείξει ότι εάν το στοιχείο στερείται, καρδιακές προσβολές, εγκεφαλικά επεισόδια, καρκίνο συμβαίνουν και ο ιός της ηπατίτιδας γίνεται ενεργός.
</ p>


