Τι είναι η αμμωνία; Τύπος και ιδιότητες της αμμωνίας
Η αμμωνία είναι μια ένωση που είναι η πιο σημαντικήμια πηγή αζώτου για τους ζωντανούς οργανισμούς, και βρήκε επίσης χρήση σε διάφορες βιομηχανίες. Τι είναι η αμμωνία, ποιες είναι οι ιδιότητές της; Ας το καταλάβουμε.
Τι είναι η αμμωνία: τα κύρια χαρακτηριστικά
Η αμμωνία (νιτρίδιο του αγωγού νερού) είναι μια ένωση αζώτου με υδρογόνο, που έχει τον χημικό τύπο ΝΗ3. Το σχήμα του μορίου μοιάζει με μια τριγωνική πυραμίδα με το άτομο αζώτου στην κορυφή της.

Η αμμωνία είναι αέριο που δεν έχει χρώμα, αλλά έχει ιδιαίτερη οσμή. Η πυκνότητα της αμμωνίας είναι σχεδόν η μισή του αέρα. Σε θερμοκρασία 15 ° C oC είναι 0,73 kg / m3. Η πυκνότητα υγρού αμμωνίας υπό κανονικές συνθήκες είναι 686 kg / m3. Το μοριακό βάρος της ουσίας είναι 17,2 g / mol. Ένα χαρακτηριστικό γνώρισμα της αμμωνίας είναι η υψηλή διαλυτότητα του στο νερό. Έτσι, σε θερμοκρασία 0 ° C, η τιμή του φτάνει περίπου 1200 όγκους στον όγκο του νερού, στους 20 ° C - 700 όγκους. Το διάλυμα "αμμωνία-νερό" (νερό αμμωνίας) χαρακτηρίζεται από μια ελαφρώς αλκαλική αντίδραση και μάλλον μοναδική ιδιότητα σε σύγκριση με άλλα αλκάλια: με την αύξηση της συγκέντρωσης μειώνεται η πυκνότητα.
Πώς σχηματίζεται η αμμωνία;
Τι είναι η αμμωνία στο ανθρώπινο σώμα; Αυτό είναι το τελικό προϊόν του μεταβολισμού του αζώτου. Το μεγαλύτερο μέρος του ήπατος μετατρέπεται σε ουρία (καρβαμίδιο) - μια λιγότερο τοξική ουσία.
Η αμμωνία σε φυσικές συνθήκες σχηματίζεται ως αποτέλεσμα της αποσύνθεσης οργανικών ενώσεων που περιέχουν άζωτο. Για χρήση στη βιομηχανία αυτή η ουσία παράγεται με τεχνητά μέσα.
Παραγωγή αμμωνίας σε βιομηχανικές και εργαστηριακές συνθήκες
Σε βιομηχανικές συνθήκες, η αμμωνία παράγεται με καταλυτική σύνθεση από άζωτο και υδρογόνο:
Ν2 + 3Η2 → 2NH3 + Q.
Η διαδικασία απόκτησης της ουσίας πραγματοποιείται στοθερμοκρασία 500 ° C και πίεση 350 atm. Ως καταλύτης χρησιμοποιείται πορώδης σίδηρος. Η προκύπτουσα αμμωνία αφαιρείται με ψύξη. Το άζωτο και το υδρογόνο, που δεν έχουν αντιδράσει, επιστρέφουν στη σύνθεση.
Υπό συνθήκες εργαστηρίου, αμμωνία παρασκευάστηκε ουσιαστικά με ασθενές θέρμανση ενός μίγματος που αποτελείται από χλωριούχο αμμώνιο και υδράσβεστο:
2ΝΗ4Cl + Ca (OH)2 → CaCl2 + 2ΝΗ3↑ + 2Η2Ο.
Για ξήρανση, η τελική ένωση διέρχεται μέσω μίγματος ασβέστου και καυστικής σόδας. Πολύ ξηρή αμμωνία μπορεί να ληφθεί με διάλυση μεταλλικού νατρίου σε αυτό και στη συνέχεια με απόσταξη.
Πού χρησιμοποιείται η αμμωνία;
Το νιτρίδιο του υδρογόνου χρησιμοποιείται ευρέως σε διάφοραβιομηχανίες. Τεράστιες ποσότητες που χρησιμοποιούνται για την παραγωγή νιτρικού οξέος και διάφορα λιπάσματα (ουρία, νιτρικό αμμώνιο, κλπ), Πολυμερή, υδροκυάνιο, νατρίου, άλατα αμμωνίου, και άλλα είδη χημικής παραγωγής.

Στην ελαφρά βιομηχανία, οι ιδιότητες της αμμωνίαςΧρησιμοποιούνται για τον καθαρισμό και τη βαφή υφασμάτων όπως το μετάξι, το μαλλί και το βαμβάκι. Στη χαλυβουργία, χρησιμοποιείται για να αυξήσει την σκληρότητα του χάλυβα με την κορεσμό των επιφανειακών στρωμάτων του με άζωτο. Τα απόβλητα οξέων εξουδετερώνονται στη βιομηχανία πετροχημικών με τη βοήθεια νιτριδίου υδρογόνου.
Λόγω των θερμοδυναμικών ιδιοτήτων του, η υγρή αμμωνία χρησιμοποιείται ως ψυκτικό μέσο στον ψυκτικό εξοπλισμό.
Ένα διάλυμα του νιτριδίου του υδρογόνου (αμμωνία) χρησιμοποιείται στην ιατρική για την απομάκρυνση της συγκοπής, έμετος διέγερση, για τη θεραπεία των χεριών ιατρικού προσωπικού, τσιμπήματα εντόμων, και ούτω καθεξής.

Ορισμένες χημικές ιδιότητες της αμμωνίας
Το νιτρίδιο του υδρογόνου χαρακτηρίζεται από μάλλον υψηλή χημική δραστικότητα και είναι ικανό να αντιδρά με πολλές ουσίες.
Όταν η αμμωνία αντιδρά με οξέα, σχηματίζονται τα αντίστοιχα άλατα αμμωνίου. Έτσι, για παράδειγμα, ως αποτέλεσμα της αντίδρασης με νιτρικό οξύ, σχηματίζεται νιτρικό αμμώνιο:
NH3 + ΗΝΟ3 → ΝΗ4Όχι3.
Στην αντίδραση με HCl σχηματίζεται χλωριούχο αμμώνιο:
NH3+ ΗΟΙ → ΝΗ4Cl.

Τα άλατα αμμωνίου είναι στερεάκρυσταλλικές ουσίες, που αποσυντίθενται στο νερό και διαθέτουν τις ιδιότητες που είναι εγγενείς στα μεταλλικά άλατα. Τα διαλύματα των ενώσεων που σχηματίζονται ως αποτέλεσμα της αλληλεπίδρασης της αμμωνίας και των ισχυρών οξέων έχουν μια ασθενώς όξινη αντίδραση.
Λόγω των ατόμων αζώτου, το νιτρίδιο του υδρογόνου είναιενεργό αναγωγικό παράγοντα. Οι μειωτικές ιδιότητές του εκδηλώνονται όταν θερμαίνονται. Όταν καίγεται σε ατμόσφαιρα οξυγόνου, σχηματίζει άζωτο και νερό. Υπό την παρουσία καταλυτών, η αλληλεπίδραση με οξυγόνο δίνει νιτρικό οξείδιο. Το νιτρίδιο του υδρογόνου έχει την ικανότητα να μειώνει τα μέταλλα από τα οξείδια.
Τα αλογόνα σχηματίζουν μια αντίδραση με την αμμωνίαΤα αλογονίδια αζώτου είναι επικίνδυνα εκρηκτικά. Όταν αλληλεπιδρούν με καρβοξυλικά οξέα και τα παράγωγά τους, το νιτρίδιο υδρογόνου σχηματίζει αμίδια. Σε αντιδράσεις με άνθρακα (στους 1000 ° C) και μεθάνιο, δίνει κυανιούχο οξύ.
Με τα μεταλλικά ιόντα, η αμμωνία σχηματίζει αμινοσυμπλέγματα,ή αμμωνία (σύνθετες ενώσεις) που έχουν ένα χαρακτηριστικό γνώρισμα: ένα άτομο αζώτου συνδέεται πάντα με τρία άτομα υδρογόνου. Ως αποτέλεσμα της συμπλοκοποίησης, το χρώμα της ουσίας αλλάζει. Έτσι, για παράδειγμα, ένα μπλε διάλυμα θειικού χαλκού με την προσθήκη νιτριδίου υδρογόνου αποκτά έντονο μπλε-ιώδες χρώμα. Πολλά από τα αμινοσυμπλέγματα διαθέτουν επαρκή σταθερότητα. Λόγω αυτού, μπορούν να ληφθούν σε στερεή μορφή.

Στην υγρή αμμωνία, τόσο οι ιονικές όσο και οι μη πολικές ανόργανες και οργανικές ενώσεις είναι εύκολα διαλυτές.
Υγειονομικά και υγειονομικά χαρακτηριστικά
Η αμμωνία ταξινομείται ως η τέταρτη τάξη κινδύνου. Η μέγιστη επιτρεπόμενη μέγιστη εφάπαξ συγκέντρωση (MPC) στον αέρα των οικισμών είναι 0,2 mg / m3, ο μέσος όρος ημερησίως - 0,04. Στον αέρα της περιοχής εργασίας, η περιεκτικότητα σε αμμωνία δεν πρέπει να υπερβαίνει τα 20 mg / m³. Σε τέτοιες συγκεντρώσεις, η μυρωδιά της ουσίας δεν γίνεται αισθητή. Σταθεροποιείται με ανθρώπινη οστίση στα 37 mg / m³. Δηλαδή, αν αισθανθεί η μυρωδιά της αμμωνίας, αυτό σημαίνει ότι τα επιτρεπτά πρότυπα για την ύπαρξη της ύλης στον αέρα είναι σημαντικά υπέρβαρα.
Επιρροή στο ανθρώπινο σώμα
Τι είναι η αμμωνία όσον αφορά τις επιπτώσεις στηντο άτομο; Είναι τοξικό. Είναι ταξινομημένη ως μια ουσία ικανή να ασκεί ασφυκτική και νευροτροπική επίδραση, δηλητηρίαση από εισπνοή, η οποία μπορεί να οδηγήσει σε πνευμονικό οίδημα και βλάβη στο νευρικό σύστημα.
Ο ατμός αμμωνίας ερεθίζει το δέρμακαλύπτει, τους βλεννογόνους των οφθαλμών και τα αναπνευστικά όργανα. Η συγκέντρωση της ουσίας στην οποία εκδηλώνεται ερεθισμός του λαιμού, είναι 280 mg ανά cc. μέτρο, μάτι - 490 mg ανά κυβικό μέτρο. μετρητή. Ανάλογα με την ποσότητα του υδρογόνου στο νιτρίδιο του αέρα μπορεί να συμβεί πονόλαιμο, κοπιαστική αναπνοή, βήχας, πόνος του οφθαλμού, υπερβολική δακρύρροια, χημικό έγκαυμα του κερατοειδούς, απώλεια της όρασης. Με περιεκτικότητα αμμωνίας 1,5 g ανά κυβικό μέτρο. μετρητής για μια ώρα αναπτύσσει τοξικό πνευμονικό οίδημα. Κατά την επαφή της υγρής αμμωνίας και των λύσεων της (σε υψηλές συγκεντρώσεις) από πιθανές ερυθρότητα του δέρματος, φαγούρα, κάψιμο και δερματίτιδα. Από υγροποιημένου αγωγού νιτρίδιο απορροφά θερμότητα κατά την εξάτμιση είναι δυνατόν κρυοπαγήματα διάφορους βαθμούς.
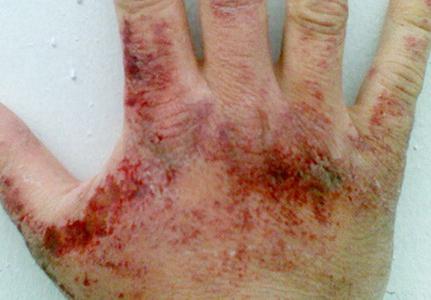
Συμπτώματα δηλητηρίασης με αμμωνία
Μπορεί να προκαλέσει δηλητηρίαση από αυτό το τοξικόμείωση της ακοής όριο, ναυτία, ζάλη, κεφαλαλγία, και ούτω καθεξής. Υπάρχουν αλλαγές στη συμπεριφορά, ιδιαίτερα έντονη διέγερση, παραλήρημα. Η εκδήλωση συμπτωμάτων σε ορισμένες περιπτώσεις είναι διαλείπουσα. Μπορούν να σταματήσουν για λίγο, και στη συνέχεια να ανανεωθεί με ανανεωμένη σφρίγος.
Λαμβάνοντας υπόψη όλες τις πιθανές συνέπειες της έκθεσης στην αμμωνία, είναι πολύ σημαντικό να τηρούνται οι προφυλάξεις κατά την εργασία με την ουσία αυτή και να μην υπερβαίνει η συγκέντρωσή της στον αέρα.
</ p>


